Inimese mikrobioota koostis ja selle tähtsus depressioon
Enne, kui süveneme täpsemalt, kuidas on seotud depressioon ja soolestiku mikrobioom, teeme selgeks, mida üldse bakterid meie organismis korda saadavad ja kui suur on nende tähtsus. Teatavasti elab koos inimese keharakkudega tasakaalustatud koosluses triljoneid baktereid, viirusi, seeni, protozoasid: 1014 mikroobirakku ja üle 2000 erineva liigi. Sellist kooslust nimetatakse superorganismiks, milles mikroobide ja keharakkude ristkõne (cross talk) määrab superorganismi bioloogilisi omadusi. Mikrobioota kujuneb sünniga ja esimestel eluaastatel, säilides tervel inimesel ja enamasti taastudes ilma vahelesegamiseta. Keskkonna ja elustiili muutused ohustavad seda kooslust, kutsudes esile olulisi tervisehäireid.
Üle 80% surmadest tsiviliseeritud ühiskondades on tänaseks põhjustatud mittenakkuslikest haigustest, nagu 2. tüüpi diabeet, rasvumine, ajuinsult ja südame-vereringe haigused. Suurenenud on ka seedetraktist lähtuvate haiguste arv, just põletikulised ja autoimmuun-haigused. Eeskätt seostatakse neid haigusi elanikkonna vananemisega, vähese füüsilise aktiivsusega, eriliste söömisharjumustega, kaloriterikka dieedi ja inimese mikrobioota muutustega (düsbioos).
Ajalooliselt peeti inimese soolestikus arvukamateks ja olulisimateks bakteriteks bakteroide, bifidobaktereid, anaeroobseid kokke, samuti väiksemates hulkades esinevaid klostriide, enterobaktereid, laktobatsille, streptokokke ja stafülokokke. Nimetatud mikroobiperekondadest leiti ka sagedasemaid bakterieemia ja põletike tekitajaid, nagu kolibakterid, stafülokokid ning anaeroobsed klostriidid ja bakteroidid. Uued võimalused mikrobioota koostise ja omaduste selgitamiseks tekkisid seoses molekulaarsete meetodite arenguga. Kasutusele võeti mikroobigruppide fülogeneetiline süsteem geeniinfo alusel (1, 2). Seedetrakti tuum-mikrobioota (core microbiota) koostisesse kuulub neli tähtsamat hõimkonda: 28-40% ulatuses Firmicutes baktereid (palju erinevaid perekondi, liike; üle 100 erineva laktobatsilli liigi); 20-38% ulatuses Bacteroidetes baktereid (bakteroidid, prevotellad, porfüromoonas); 3-10% osas Actinobacteria (bifidobakterid) ja Proteobacteria (enterobakterid) hõimkonna baktereid.
Inimese mikrobiootat iseloomustab hõimkondade, perekondade ja liikide arvukus (biodiversiteet) ja kindel tasakaal omavahelistes arvulistes suhetes. Kui inimesel endal on genoomis ligikaudu 20-30 tuhat geeni, siis mikrobioom (mikroobide geneetiline informatsioon) koosneb mitusada korda enamast, kuni paarist miljonist geenist. Mikrobioota hõimkondade osakaalu laia variatsiooniga kaasnevad bakterite liikide ja mikroobitüvede individuaalsed erinevused (9). Molekulaarsete markerite alusel on võimalik kindlaks teha iga isiku mikrobioota variandid – personaalne mikrobioom (3).
Mikrobioota metaboliidid ehk postbiootikumid ja nende toimemehhanismid
Aktiivne mikrobioota tekitab soolde rohkelt imenduvaid aineid, mis kudedes ja veres osalevad mitmetes organismi füsioloogilistes funktsioonides (4). Näiteks uusimateks avastatuteks osutusid mittepatogeensete kasulike klostriidide klaster (Clostridium IV, XIVa, sh. Faecalibacterium prausnitzii), mis metaboliit võihappega lülitub kompleksesse ainevahetusse. Kasulike bakteritena toodavad bifidobakterid äädikhapet, etanooli, sipelghapet, H2 ja CO2. Laktobatsillide metaboolseks põhikomponendiks on laktaat, aga heterofermentatiivsed laktobatsillid tekitavad lisaks laktaadile äädikhapet, suktsiinhapet, etanooli, NO, CO2, H2.
Mitmed neist postbiootikumidest on põhilisteks energiaallikateks soole limaskesta rakkudele, samuti neutraliseerivad need mõnede toksigeensete ja kartsinogeensete metaboliitide (biogeensed amiinid, parakresool, fenool, indool, teisesed sapihapped, SO2, NH3) kahjustavat mõju. Soole epiteelirakkude liitekohtade tihendamine väldib kahjulike molekulide, näiteks gram-negatiivsete bakterite endotoksiini lipopolüsahhariidi (LPS) translokatsiooni verre. (5, 6).
Soole mikrobioota süsteemset mõju ainevahetusele ja organite funktsioonile, sh ajule, südame-veresoonkonnale, maksale ja immuunsüsteemile kinnitavad mitmed uuringud (7, 8). Allpool toodud skeem (Joonis 1) peegeldab mikrobioota eri komponentide teaduspõhiselt tõestatud toimeid. Neist olulisemad on mikrobioota struktuuri tasakaalustamine, rakuline ja humoraalne immuunmodulatsioon, metaboolne toime ainevahetusele.
Mikrobiootal on nii lokaalne kui süsteemne mõju immuunsüsteemile. Erinevad bakterid ja seened mõjutavad nii spetsiifilist kui mittespetsiifilist immuunvastust fagotsüütide ja makrofaagide aktiveerimisega, indutseerides tsütokiine ja defensiine, tõstes sekretoorse IgA taset (9). Mikrobioota metaboolne toime seostub oksüdatiivse stressi vähendamisega ning vereseerumi toksiinide ja mutageenide neutraliseerimisega, vähendades nii jämesoole vähi riski.
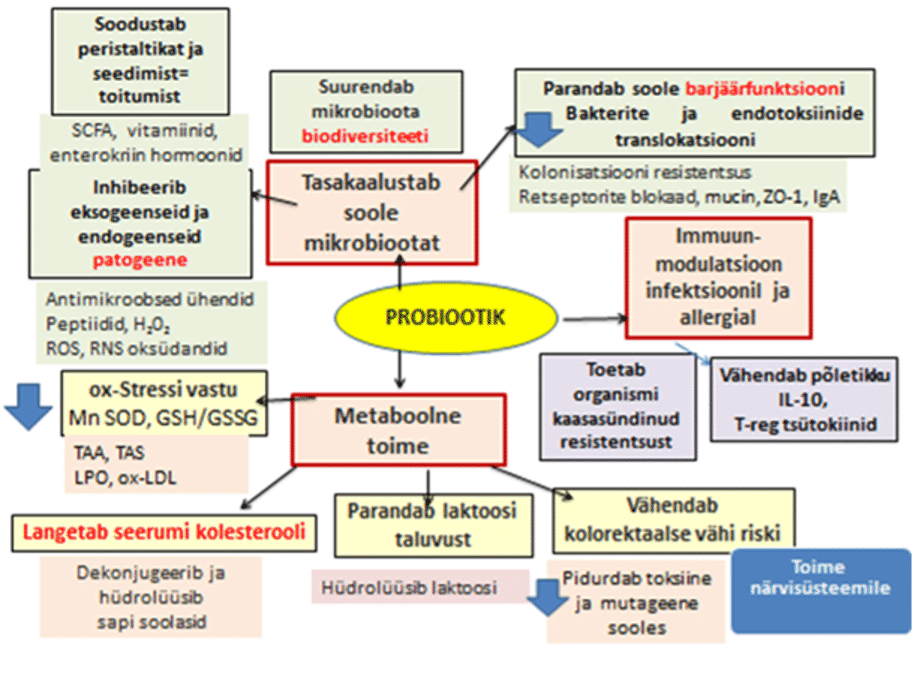
Joonis 1. Mikrobioota ja sellest arendatud probiootikumide toimemehhanismid (10-12).
Epigeneetiline efekt
Viimastel aastatel on selgunud, et inimese omadused ja haiguste ilmnemine ei ole määratud ainult vanemate poolt päritud geenidega, vaid on ka epigeneetiliselt (lad.k. epi järel) mõjustatud. Epigeneetiline toime muudab rakkude geenide ekspressiooni või supressiooni ilma DNA nukleotiidide järjestusi muutmata (13), lisades või eemaldades DNA-le, kromatiinile, histoonidele molekulaarseid keemilisi märgiseid (ingl. k. tag), näiteks metüül- või atsetüülgruppe. Epigeneetiliste mõjudena toimivad keskkond, vanus, dieet, sotsiaal-ökonoomilised faktorid, ravimid, persisteerivad infektsioonid, mitmesuguste haigused, mille mehhanismid kõik ootavad täpsemaid selgitusi. Võib oletada, et erinevused inimeste vananemises on samuti epigeneetilise mehhanismiga.
Nagu eelpool mainitud on predominantsete seas 2 hõimkonda: Firmicutes ja Bacteroides, kuid individuaalne varieeruvus on suur.
Seedetrakti ja aju vahel eksisteerib kahesuunaline kommunikatsiooni rada, mida nimetatakse mikrobioota-seedetrakt-aju teljeks, mis pidevalt vahendab informatsiooni perifeeria ja aju vahel. Kommunikatsiooni rada sisaldab neutraalset (vagus närv ja enteeriline närvisüsteem), endokriinset (kortisool ja mikrobioota-seedetrakt-aju telg), immunoloogilst (tsütokiinid) rada.
Muutused seedetrakti mikrobiootas ja depressioon
Kliinilised uuringud on näidanud erinevust mikrobiootas neuroloogiliste häiretega patsientide ja tervete inimeste vahel, 16S rRNA faces`e mikrobioota analüüside alusel.
Patsientidel, kel oli diagnoositud depressioon, oli Lachnospiraceae ja Ruminococcaceae (Phylum Firmicutes) perekondade mikroobide hulk vähenenud, kusjuures liigiliselt olid statistiliselt tõenäoliselt vähenenud Faecalibacterium ja Ruminicoccus. (14). Samuti oli vähenenud lactobacillide ja bifidobacterite hulk (15). Bacteroides hulk oli depressiooni diagnoosiga haigetel suurem ja Lachospiraceae hulk väiksem võrreldes tervetega (28). samuti oli vähenenud Firmicutes ekspressioon ja suurenenud Proteobacteria (bifidobakterid) ja Actinobacteria (enterobakterid) ekspressioon. Esines seos ka mikrobioota, depressiooni ja maksa funktsiooni vahel. Seedetrakti metaboliitide (LPS jt.) signaalid toimuvad teljel seedetrakt – maks – aju, kusjuures metaboliidid võivad sattuda portaalveeni kaudu otse maksa ja põhjustada maksa põletiku (16). Lisaks otsesele maksa kahjustuse suurendamisele võivad bakterid ja nende metaboliidid indutseerida põletiku ajus veres tsirkuleerivate tsütokiinide kaudu, mis omakorda mõjutavad mitmeid ajus toimuvaid protsesse mõjutades /kahjustades meeleolu ja käitumist (17). Seedetrakti poolt esile kutsutud põletik ja selle tagajärjed nihutavad Trp metabolismi kinureniini biosünteesi suunas, mis katkestab seratoergilise signaali, tingides mitmeid neuroloogilisi probleeme sh. depressiooni.
Muutused seedetrakti mikrobiootas võivad suurendada soole barjääri permeaablust, aktiveerida süsteemset põletikku ja immuunvastust, reguleerida monoamiino, neurotransmitterite (neuroloogilised ülekandemolekulid) vabastamist, mõjutades hüpotaalamus – hüpofüüs – neerupealise säsi (adrenaliin) telge ja modifitseerides aju neurotroofse faktori (brain –derived neurotrophic factor – BDNF) hulka, mis viibki lõppkokkuvõttes depressiooni tekkele (18).
Probiootikumide mõju depressiooni puhul
Probiootikumina mõistetakse elusaid mikroorganisme, mille kindlates hulkades kasutamine mõjutab positiivselt inimese tervist. Koos prebiootikumidega (sageli taimset päritolu, peensooles mitteimenduvad dieet-kiudained, kõrgmolekulaarsed suhkrud, alkoholid) moodustavad need sünbiootikumi. Sünbiootikumi koostisse kuuluvad mitmesugused prebiootikumid, mida USA Ravimikontrolli Amet (ingl. k. Federal Drug Agency, FDA) on aktsepteerinud: 26 erinevat kasuliku prebiootilise efektiga dieet-kiudainet, näit. polüdekstroos, galaktooligosahhariidid, inuliin, seedimatu tärklis. Sarnaselt toimivad ka kiudaineterikkad toiduained, nagu juurviljad, täisteraviljad, maisihelbed. Kasulike efektidena esitatakse veresuhkru ja kolesterooli füsioloogilist langetamist, vererõhu regulatsiooni, parendatud seedefunktsiooni ja mineraalide imendumist, täiskõhutunde teket).
Probiootikumid võivad tugevdada immuunsüsteemi, mõjutada naha mikrobiootat, suurendada resistentsust allergeenidele, vähendada patogeenide hulka, samuti kaitsta DNA, lipiide ja valke oksüdatiivsete (ROS – reaktiivsete hapniku osakeste) kahjustuste eest.
Stress ja probiootikumid – seedetrakt – aju telje hüperaktiivsus on suurim riskifaktor depressiooni tekkeks.
Probiootikumid osalevad ka kahesuunalises kommunikatsioonis seedetrakti ja aju vahel (19). Nii seedetrakti mikrobioota kui probiootikumid mõjutavad nii immuun- kui kesknärvi-süsteemi, kuid ka patogeenseid mikroorganisme seedetraktis, kuna seedetrakti mikroorganismid võivad produtseerida ja edasi kanda neuroaktiivseid aineid nagu serotoniin ja gamma-aminovõihape (GABA) (20).
GABA on põhiline inhibeeriv ülekandemolekul ajus, osaledes paljudes füsioloogilistes ja psühholoogilistes protsessides on GABA süsteemi düsfunktsionaalsus seotud paljude psüühiliste häiretega sh ka depressiooniga. Lactobacillus brevis ja Bifidobacterium dentium on efektiivsed GABA tootjad, nad on võimelised optimaalselt metaboliseerima Na-glutamaati produtseerides GABA.
Loomkatses on näidatud, et probiootikumide tarvitamine (Bifidobacterum infantis) võib viia plasma Trp taseme suurenemisele ja serotoniini ja kortikaalsete dopamiini metaboliitide taseme vähenemisele frontaal ajukoores, vähendades depressiooni sümptomeid (21).
Samuti on mitmed probiootikumid vähendanud psüühilise stressi taset, sh ka depressiooni skoore ja tõstnud tuju (Bifidobacterum breve*, B. Longum*, B. Bifidum, ja Lactobacillus acidophilus*, L. Bulgaricus*, L. Casei*, L. Brevis*, L. salivarius jt) cross ref. (22). * Nimetatud tüved esinevad Dr.OHHIRA® probiootikumide koostises
Autor: Dr. Tiiu Kullisaar, TÜ meditsiinilise biokeemia professor
Dr.OHHIRA® probiootikumid, mida soovitame meeleoluhäirete puhul:
| Dr.OHHIRA® 3-aastane retsept | Dr.OHHIRA® Deluxe | Dr.OHHIRA® prebiootiline pasta |
 |
 |
 |
| Sisaldab arvestataval määral elavaid Lactobacillus ja Bifidobacterum piimhappebaktereid, prebiootikume ning mõnevõrra postbiootilisi ühendeid. | Sisaldab elavaid Lactobacillus ja Bifidobacterum piimhappebaktereid, prebiootikume ning arvestatavas koguses kontsentreeritud postbiootilisi ühendeid sh. neurotransmittereid, mis soodustavad aju-soolestiku kommunikatsiooni. | Sisaldab Lactobacillus ja Bifidobacterum piimhappebaktereid, postbiootilisi ühendeid ning suures koguses soolestiku bakterikoosluse terviklikkust ja mitmekesisust soodustavaid prebiootikume. |
| VAATA TOODET | VAATA TOODET | VAATA TOODET |
Kasutatud allikad:
- Roager HM, Licht TR, Poulsen SK, et al: Microbial enterotypes, inferred by the prevotella-to-bacteroides ratio, remained stable during a 6-month randomized controlled diet intervention with the new nordic diet. Appl Environ Microbiol 2014; 80:1142-1149 Chow J, Lee SM, Shen Y, et al: Host-bacterial symbiosis in health and disease. Adv Immunol 2010; 107:243-274
- Lloyd-Price J, Mahurkar A, Rahnavard G, et al: Strains, functions and dynamics in the expanded Human Microbiome Project. Nature 2017; 550:61-66
- Nicholson JK, Holmes E, Kinross J, et al: Host-gut microbiota metabolic interactions. Science 2012; 336:1262-1267
- Cani PD, Amar J, Iglesias MA, et al: Metabolic Endotoxemia Initiates Obesity and Insulin Resistance. Diabetes 2007 56:1761-1772
- Xiao S, Fei N, Pang X, et al: A gut microbiota-targeted dietary intervention for amelioration of chronic inflammation underlying metabolic syndrome. FEMS Microbiology Ecology 2014; 87:357-367
- Delzenne NM, Neyrinck AM, Backhed F, et al: Targeting gut microbiota in obesity: effects of prebiotics and probiotics. Nat Rev Endocrinol 2011; 7:639-646
- Sun J,Chang EB: Exploring gut microbes in human health and disease: Pushing the envelope. Genes Dis 2014; 1:132-139
- Senok AC, Ismaeel AY,Botta GA: Probiotics: facts and myths. Clin Microbiol Infect 2005; 11:958-966
- Patel RM,Denning PW: Therapeutic use of prebiotics, probiotics, and postbiotics to prevent necrotizing enterocolitis: what is the current evidence? Clin Perinatol 2013; 40:11-25
- Sanders ME: Impact of probiotics on colonizing microbiota of the gut. J Clin Gastroenterol 2011; 45 Suppl:S115-119
- Mikelsaar M, Sepp E, Stsepetova J, et al: Biodiversity of Intestinal Lactic Acid Bacteria in the Healthy Population. Adv Exp Med Biol 2016; 932:1-64
- Ley RE, Peterson DA,Gordon JI: Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell 2006; 124:837-848
- Kelly, P.J. Kennedy, J.F. Cryan, T.G. Dinan, G. Clarke, N.P. Hyland. Breaking down the barriers: the gut microbiome, intestinal permeability and stress- related psychiatric disorders Front. Cell. Neurosci., 9 (2015), p. 392.
- R. Kelly, Y. Borre, C. O’Brien, E. Patterson, S. El Aidy, J. Deane, P.J. Kennedy, S. Beers, K. Scott, G. Moloney, A.E. Hoban, L. Scott, P. Fitzgerald, P. Ross, C. Stanton, G. Clarke, J.F. Cryan, T.G. Dinal Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat J. Psychiatr. Res., 82 (2016), pp. 109-118.
- C Patel, et al. Clinical Science Workshop: targeting the gut- liver- brain axis,Metab. Brain Dis.31(6) (2016), 1327-1337.
- Federico et al., Gut microbiota and liver. Minerva Gastrorol. Dietol. 63 (4);(2017), 385-398.
- Waclawikova B., El Aidy S. Role of microbiota and tryptophan metabolites in the remote effect of intestinal inflammation on brain and depression. Pharmaceuticals (Basel) 2018;11(3).
- Dinan T.G., Cryan J.F. Melancholic microbes: A link between gut microbiota and depression? Neurogastroenterol. Motil. 2013;25:713–719. doi: 10.1111/nmo.12198.
- Kelly J.R., Clarke G., Cryan J.F., Dinan T.G. Brain-gut-microbiota axis: Challenges for translation in psychiatry. Ann. Epidemiol. 2016;26:366–372. doi: 10.1016/j.annepidem.2016.02.008.
- Desbonnet L., Garrett L., Clarke G., Bienenstock J., Dinan T.G. The probiotic Bifidobacteria infantis: An assessment of potential antidepressant properties in the rat. J. Psychiatr. Res. 2008;43:164–174. doi: 10.1016/j.jpsychires.2008.03.009.
- Ruixue Huang, Ke Wang and Jianan Hu Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials Nutrients. 2016; 8(8): 483.

